机体内的MSC广泛存在于基质中和血管周,甚至曾认为MSC属于周细胞(pericyte)[1, 2]。大量的研究显示MSC分泌多种营养性因子或生长因子,通过旁分泌作用促进多种细胞的存活[3-7]。MSC还能减少炎症和减少组织细胞的凋亡[8],促进内源性组织器官的干祖细胞的增殖[9, 10],从而达到修复组织器官的效果。那么机体自身MSC是否受到损伤,很大程度上决定机体自我修复功能是否健全。

第一部分
糖尿病整体环境损伤MSC
糖尿病的病理生理很复杂,血糖控制不好,容易累及多器官病变。糖尿病患者最基本的病理改变在于晚期糖基化终末产物(AGEs)的积累增多所致。AGEs形成后,通过介导胞内线粒体呼吸链蛋白的糖基化,产生过多的活性氧簇(ROS),氧自由基损伤胞内的内质网,同时损伤细胞膜,从而引起慢性炎症反应[11-14]。长期的慢性炎症损伤患者自体MSC,使得自体MSC的增殖能力下降,难于获得足够的MSC细胞数来回输治疗[15],而且患者自体MSC的生长因子和细胞因子分泌数量和种类减少,导致自体MSC抗纤维化、消炎能力和促进血管新生能力受到损伤。
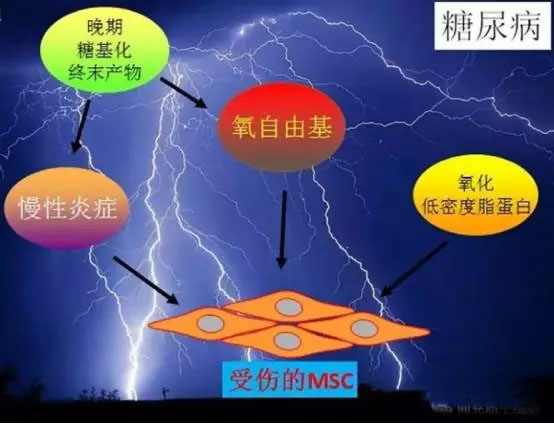
AGEs能刺激ROS的长生增多,而ROS对健康MSC亦有直接的损伤,包括损伤MSC的增殖能力、迁移和粘附、细胞因子分泌谱改变、诱导凋亡等[13, 14, 18],因此,减少干细胞胞内氧自由基的堆积,有利于保持干细胞的健康状态。有意思的是,虽然AGE损伤骨髓MSC的干性,如果骨髓MSC高表达Nanog和Oct4,那么I型糖尿病骨髓MSC的抗凋亡能力得到一定的提高,而且阻断AGE受体介导的信号通路在一定程度上保护了骨髓MSC。
炎症因子TNF-α不仅能通过激活下游的NFκB通路损伤健康骨髓MSC,而且亦能增加糖尿病患者骨髓MSC的凋亡,导致糖尿病患者骨髓MSC的数量减少,阻断TNF-α的活性有利于恢复糖尿病患者骨髓MSC的促进组织再生的能力[20]。虽然有研究显示糖尿病大鼠骨髓MSC依然能分泌趋化因子和促进内皮细胞形成血管结构[21],但是用糖尿病患者的血清培养健康者骨髓MSC,则出现健康MSC的促血管新生能力显著下降,同时伴随着趋化能力的下降[22],其原因可能在于糖尿病患者血液中富含的氧化低密度脂蛋白(ox-LDL)能损伤骨髓MSC的胞膜,导致MSC死亡,而且抗氧化剂N-乙酰半胱氨酸并不能抵抗氧化低密度脂蛋白对MSC的损伤。

糖尿病骨髓微环境亦损伤MSC
长期高血糖可以引起长骨骨小梁结构的重构,导致骨髓腔微环境的改变[24]。骨髓微环境的改变能影响到骨髓腔干细胞龛(niche)的微环境及干细胞的功能[25]。糖尿病患者的骨髓微环境重构的原因有[25, 26]:①骨微结构改变:脂肪沉淀增多,骨髓MSC成骨分化功能受损导致成骨祖细胞的减少[27-29];②微血管障碍:骨髓腔内血管通透性改变,导致干细胞龛出现血液灌注不足[30, 31];③骨髓神经病变:糖尿病患者骨髓神经病变导致伤害感受无法正常传递到骨髓MSC,使得骨髓MSC未能感受到组织损伤的信号,骨髓MSC处于无应答状态[32]。也有研究显示是糖尿病骨髓里面的M1型巨噬细胞增多,限制了骨髓MSC的趋化迁移能力。
动物实验发现I型糖尿病骨髓MSC抑制免疫反应的能力下降,提示I型糖尿病骨髓微环境对MSC有损伤[34, 35]。但是I型糖尿病患者骨髓MSC的形态、免疫抑制能力和迁移能力均和健康骨髓MSC没有明显的差异[26, 36, 37]。和健康骨髓MSC相比,糖尿病小鼠骨髓MSC高分泌炎症介质:ccl-2, ccl-3, ccl-4, IL-6, IκBα, MCP-1/5, MIP-1α/β, MIP-2, TNF-α[16]。比如MIP-1α/β能吸引M1型巨噬细胞(促进炎症的巨噬细胞)趋化到损伤部位[38],这种促进炎症的巨噬细胞的聚集进一步加剧了组织的损伤和阻碍了损伤后的自体修复[39]。骨髓微环境损伤MSC的修复功能,而MSC无法正常地发挥组织损伤后的修复作用,进而加剧了糖尿病并发症的发展。
生长因子(IGF-1和bFGF)体外培养糖尿病患者骨髓MSC,通过自分泌或旁分泌机制,能促进损伤的MSC分泌多种生长因子,使得增殖能力得到恢复[40]。富血小板血栓释放上清(platelet rich clot releasate)同样起到生长因子的作用,促进损伤的MSC的功能恢复[41]。这说明糖尿病骨髓MSC的功能受损是暂时性的和可逆性的,给与恰当的治疗干预,能够逆转糖尿病骨髓微环境对MSC的损伤。
胰岛β细胞替代技术的发展,给I型糖尿病的治疗带来治愈的曙光。但II型糖尿病病生病理比I型糖尿病复杂,而且并发症和致残率高于I型糖尿病。除了控制血糖外,可能还需要综合治疗,尤其是积极预防并发症的发生。
第二部分
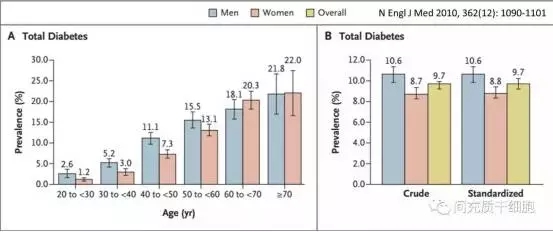
2010年著名的新英格兰医学杂志发文介绍了中国糖尿病的流行病学情况,糖尿病患者约9千万,40岁以上的发病率超过10%,其中90%为2型糖尿病[1]。高发病率和高并发症已经严重威胁到糖尿病患者生活质量和身体健康,因此,寻求有效降低和稳定血糖的治疗方法,以及预防并发症的发生,意义非凡。干细胞,尤其是间充质干细胞的出现,其独特的功能特性迅速被应用于糖尿病的治疗研究。
较早时候的动物实验证明,经过体外诱导培养,间充质干细胞(MSC)能分化为分泌胰岛素的β细胞样的细胞,降低糖尿病老鼠的血糖水平[2-4]。随后进一步发现,MSC输注后,改善胰岛β细胞的微环境,比如抑制局部的免疫反应和改善缺血缺氧,能保护胰岛β细胞免受进一步的损伤[5, 6]。因此,在MSC治疗糖尿病的临床研究中,MSC存在两种状态:①经过诱导培养,能分泌胰岛素,②不经过诱导培养。目前的临床研究中常用糖化血红蛋白(HbA1c)和胰岛素用量这两个指标来判断MSC治疗糖尿病的疗效。
1型糖尿病
1型糖尿病属于自身免疫性疾病的一种,由自身的T细胞异常激活,不断攻击胰岛的β细胞,使得β细胞凋亡或坏死,从而引起胰岛素不足而出现高血糖[8]。阻断T细胞对β细胞的破坏和促进β细胞的再生,是治愈1型糖尿病的两个策略,也是1型糖尿病研究的重点方向和巨大的挑战。
9例临床研究评估自体骨髓MSC治疗1型糖尿病的疗效,年龄18-40岁,初诊首治患者,给与自体骨髓(2.1-3.6) x 106/kg MSC外周静脉治疗;在10周和1年后的时间点,治疗组和对照组患者的糖化血红蛋白(HbA1c)和C-肽没有差异。
5例1型糖尿病酮症酸中毒患者接受健康异体骨髓MSC和对症处理,其中MSC静脉输入,按体重1 x 106/kg;1例患者在3个月内无需依赖胰岛素,2例患者在2年内胰岛素用量减少;MSC治疗有效的患者3年内的糖化血红蛋白(HbA1c)均能维持较低的水平。
28例单纯的1型糖尿病患者纳入一个随机对照双盲临床研究,所有的患者均给与常规基础治疗,其中的15例患者给与2次脐带MSC静脉输入治疗(1.5-3.2 x 107),中间相隔一个月,整个临床研究观察了2年,治疗组糖化血红蛋白(HbA1c)水平低于对照组,而且胰岛素的使用量下降约50%[11]。
从上述的三个临床研究的报道来看,暂时可以得出一些结论:①1型糖尿病患者自体骨髓MSC不适合用来自体治疗;②健康患者的MSC输入治疗可以降低胰岛素的使用量,说明胰岛β细胞的数量或功能得到一定的恢复;③临床研究例数偏少,各研究对照组病情不一致,治疗方案不一致,导致结果可能出现偏差。另有Meta分析显示脐带MSC治疗1型糖尿病的效果优于骨髓MSC,而且在诊断明确后越早治疗效果越好。
2型糖尿病
动物实验证明了MSC可以治疗II型糖尿病,提高胰岛素和C-肽的分泌量,增强胰岛素的敏感性,降低血糖水平[13, 14]。和MSC治疗其他适应症一样,多次注射MSC能维持较长的疗效时间,疗效优于单次注射[14]。
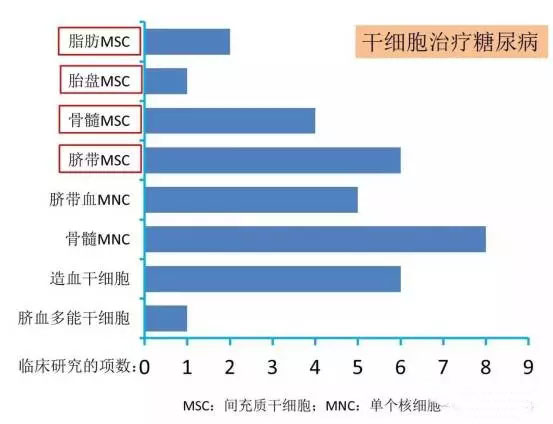
2型糖尿病的发病机制复杂,病情进展到体内胰岛素相对不足之时,需要额外注射胰岛素治疗。目前,MSC治疗2型糖尿病的出发点在于,经过MSC治疗后,患者是否能摆脱胰岛素治疗?当然,治愈糖尿病依然是一个未来的终极目标。MSC治疗2型糖尿病的总体概括见下表。
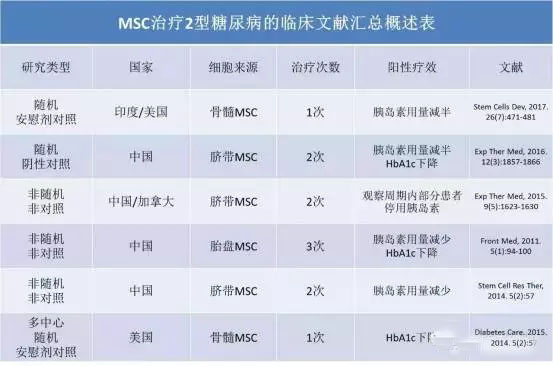
大部分临床研究均显示,MSC输入治疗后,患者胰岛素的使用量下降比较明显,而且效果能维持数月甚至一年半[15-19]。也有临床研究显示MSC并不能明显地提高2型糖尿病患者胰岛素的敏感性,不能减少胰岛素的使用量[20, 21]。下面逐一详细汇报各临床研究的基本情况。
临床报道
MSC治疗有效的临床报道
一个安慰剂对照的临床试验,同时比较评价骨髓MSC(1 x 106/kg MSC)和骨髓单个核(MNC,1 x 109/人)治疗2型糖尿病的疗效;治疗组每组均10例患者,胰腺动脉介入方法单次输注治疗;1年后,MSC治疗组患者的胰岛素使用量减半,但是糖化血红蛋白(HbA1c)和C-肽没有明显变化;MNC治疗组患者的胰岛素使用量也减半,C-肽明显提高,但是糖化血红蛋白(HbA1c)没有明显变化[15]。
61例(18-60岁)2型糖尿病患者随机分为2组,治疗组给与脐带MSC治疗,每月一次,连续2次,外周静脉输入,细胞数为(5.3-8.9) x 107,观察评价时间为3年;MSC治疗组患者的胰岛素使用量同样下降约50%,同时糖化血红蛋白(HbA1c)下降明显,但是1年半以后胰岛素使用量和和糖化血红蛋白(HbA1c)开始缓慢升高;在3年的时间点,治疗组的胰岛素使用量依然低于对照组,但是糖化血红蛋白(HbA1c)已经没有差异。
6例不伴随并发症的难治性胰岛素依赖性2型糖尿病患者(27-51岁),每2周一次,连续2次,给与(0.79-0.95) x 106/kg的脐带MSC外周静脉注射;观察周期为2年,1例患者在3个月、2例患者在6个月摆脱胰岛素治疗,而且C-肽水平随着升高;剩下3例患者的胰岛素使用量在6个月后开始恢复到治疗前的水平,甚至有2例超过之前的用量[17]。
10例胰岛素依赖性2型糖尿病患者(48-82岁),均有严重的心肾血管疾病并发症接受胎盘来源的MSC治疗,每月一次,连续3次,外周静脉输入,(1.22–1.51) x 106/kg;6个月后,患者体内的胰岛素水平升高,提示胰岛β细胞的功能得到一定程度的恢复,而且4例患者胰岛素的使用量减半,所有患者的糖化血红蛋白(HbA1c)均显著下降[18]。
22例不伴随并发症的2型糖尿病患者(18-70岁),17例同时接受口服降糖药和胰岛素治疗,先给与外周静脉输入脐带MSC,5天后给与胰腺动脉介入方式输入同量的MSC,1 x 106/kg;一个月后,糖化血红蛋白(HbA1c)和C-肽轻微改善,此后至1年的时间内胰岛素用量逐渐减少至一半;虽然胰岛素用量一年内持续下降,但一个月后患者的餐后血糖和糖化血红蛋白(HbA1c)维持稳定水平,HbA1c并不随着胰岛素用量减少而下降,而且治疗前后的空腹血糖没有变化;意外的是,患者体内的CD3+T淋巴细胞和CD4+T淋巴细胞的数量均下降[19]。
MSC治疗无效的临床报道
一个多中心随机安慰剂对照临床试验,不伴随并发症的2型糖尿病患者,口服降糖药不能稳定血糖,而且使用胰岛素不超过7天;患者单次静脉注射异体骨髓MSC,根据MSC的细胞数不同分为3组,每组均为15例患者,0.3 x 106/kg组、1.0 x 106/kg组、2.0 x 106/kg组;12周内,2.0 x 106/kg组的患者糖化血红蛋白(HbA1c)下降明显,但是其他观察指标没有明显的改变[20]。这是一个高质量的临床研究,但是从结果来看,即使给与高剂量MSC(2.0 x 106/kg)治疗,单次注射不能让2型糖尿病患者明显收益。
18例不伴随并发症的2型糖尿病患者(23-65岁),每2周一次,连续3次,给与(1-3) x 106/kg的脐带MSC外周静脉注射;经过MSC治疗后,18例患者被分为有效组(8例)和无效组(10例);在有效组中,空腹血糖和餐后血糖有明显改善,但胰岛素使用量略为下降,从0.96到0.78 IU/day/kg(P=0.085),糖化血红蛋白(HbA1c)和C-肽没有明显变化,Treg细胞含量显著升高,但其他淋巴细胞亚群没有明显变化。
MSC和其他细胞联合使用
印度的一个研究小组不区分糖尿病的分型,而是直接将11例胰岛素依赖性糖尿病患者纳入研究组(没明确指出是哪型糖尿病,就是这么疯狂!);先在体外诱导异体脂肪来源的MSC分泌胰岛素,抽取患者骨髓进行造血干细胞培养8天后,通过手术方法,在腹部大网膜静脉注射分泌胰岛素的MSC和造血干细胞(HSC);同时给与患者200cGY连续5天的放射,以预防细胞输入引发的排异反应(这临床治疗方案也是前无古人后无来者!);观察了12个月后,9例患者的胰岛素使用量明显下降,2例患者没有明显变化[22]。该研究小组随后进行一个对照临床试验,相同的治疗方案,只是研究比较自体干细胞和异体干细胞治疗1型糖尿病的疗效差异;结果发现自体干细胞治疗的患者C-肽升高明显,而其他的指标都没有差异。
中国的一个研究小组亦开展相似但相对比较简单点的研究方案,即脐带MSC(1.0 x 106/kg)联合自体骨髓单个核(BM-MNC,106.8 x 106/kg)胰腺动脉介入方法单次输注治疗1型糖尿病;1年后,21例患者的糖化血红蛋白(HbA1c)和胰岛素使用量略为下降,分别为HbA1c从平均8.6%降到7.5%,胰岛素的用量从0.9降到0.6 IU/day/kg。
总结
从目前的临床研究的结果来看,“MSC治疗糖尿病”此论断实属不妥,因为暂时还没有严格的临床试验证明MSC可以代替常规降糖药和胰岛素。但是目前的研究都支持MSC可以应用于糖尿病患者,在一定程度上能保护胰岛β细胞的功能,提高机体对胰岛素的敏感性。胰岛素使用量的减少,将给机体带来什么好处?MSC的使用是否能维持血糖的稳定性?MSC的使用能否预防或治疗并发症?这些问题源于前期探索性临床研究,需要在未来的临床研究中解决。
另外,如果在文献中并没提及或证明所用的细胞为间充质干细胞,比如所用细胞为:骨髓干细胞(单个核细胞,MNC),则不给与引用和讨论,因为骨髓干细胞包含多种明显异质的细胞群体,而且所含的MSC数量很少。
第三部分
糖尿病的病理生理很复杂,血糖控制不好,容易累及多器官病变。糖尿病患者最基本的病理改变在于晚期糖基化终末产物(AGEs)的积累增多。AGEs形成后,通过介导胞内线粒体呼吸链蛋白的糖基化,产生过多的活性氧簇(ROS),氧自由基损伤胞内的内质网,同时损伤细胞膜,从而引起慢性炎症反应[1-4]。AGEs导致广泛性慢性炎症反应是糖尿病并发症的病理基础,微血管病变引起的供血供氧不足则是导致视网膜病变、肾衰竭和下肢溃疡的主要原因。
MSC在促进血管新生、重建血供、改善缺血等方面具有显著的优势,这也是MSC能够治疗糖尿病微血管病变的原因[5];简单来说,机理在于①MSC分泌多种促进血管新生的生长因子和②MSC促进内皮细胞增殖和迁移;
糖尿病足溃疡危害性大
2017年6月份新英格兰医学杂志发表综述,明确指出糖尿病患者足部溃疡是最常见的糖尿病并发症,约为19%-34%[6],而2005年JAMA统计的数据只是高达25%[7]。根据2015年国际糖尿病联盟(International Diabetes Federation)的统计数据,估计全球每年糖尿病患者出现足部溃疡的人数大概在9百万到2千6百万。欧洲超过一半的糖尿病足部溃疡出现各种感染[8],美国约20%的中重度感染导致患者需要截肢[9]。糖尿病患者如果出现严重的肢体缺血(尤其是下肢缺血),那么5年生存率只有50%,而且截肢后的死亡率高达25%-50%[10]。糖尿病足溃疡治愈后,如果血糖控制不稳定或平时保养不注意,糖尿病足溃疡1年内的复发率约40%、3年复发率约为60%、5年复发率约为65%[6]。
糖尿病足溃疡久经不愈,一个很重要的原因在于长期持续的糖尿病微环境损伤患者自体基质组织中的MSC的功能,尤其是增殖能力和抗凋亡能力[11, 12],导致自体MSC无法正常分泌生长因子来发挥修复作用。慢性溃疡部位的成纤维细胞衰老明显,不仅丧失迁移能力,而且转化生长因子(TGF-β)受体大幅度减少,丧失对转化生长因子刺激的应答能力[13, 14]。有学者认为参与修复的成纤维细胞来源于MSC,可能是MSC分化为成纤维细胞。
MSC治疗糖尿病足机理及临床研究
皮肤损伤后的修复,需要多种生长因子的参与,比如VEGF、HGF、FGF、EGF,阻断或封闭这些生长因子的受体,将导致机体自身的修复功能丢失,皮肤损伤部位经久不愈[18-22]。实验均证明健康的MSC能趋化到溃疡部位,旁分泌VEGF、bFGF、HIF、PDGF、KGF、EGF等,这些细胞因子促进内皮细胞增殖、新血管的形成和改善血供,从而促进糖尿病足溃疡伤口的恢复[23-28]。除了VEGF外,MSC亦分泌神经营养性生长因子(NGF和BDNF),有利于溃疡部位的周围神经病变的恢复。
MSC治疗糖尿病足溃疡常用单次局部肌肉注射方式,经过MSC治疗后,绝大部分患者的溃疡面积明显缩小。比如糖尿病足溃疡周边单次局部注射自体骨髓MSC治疗,MSC使用量为(4.5-6) x 107/人,12周后,平均溃疡面积从7.26±1.41 cm2缩小到2±0.98 cm2,溃疡部位的疼痛减轻、无痛步行距离明显增加[31]。而且随机双盲对照试验证明多位点局部注射自体骨髓MSC治疗糖尿病严重下肢缺血并发足部溃疡的疗效明显优于自体骨髓单个核细胞(MNC),评价指标包括无痛步行时间、踝肱指数、经皮氧分压等。
15名2型糖尿病患者(26-72岁)接受脐带血MSC治疗下肢缺血(糖尿病足),在缺血区周边多点注射,每点2 x 106个MSC,最长观察周期为12周;除了胰岛素用量和糖化血红蛋白(HbA1c)持续下降外,患者外周血的VEGF浓度在4周时达到峰值,而后持续下降;患者局部皮肤温度、踝肱指数、皮下氧分压等改善明显。
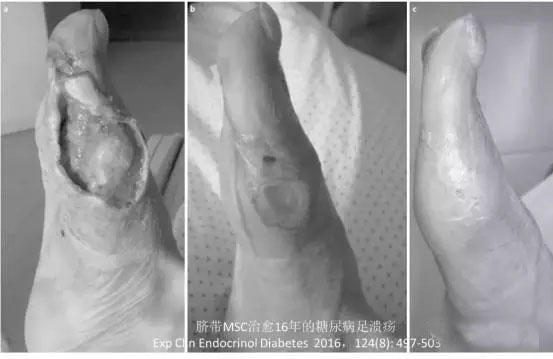
2016年的一个随机对照临床研究,评价MSC联合血管形成术治疗糖尿病足的效果,其中人脐带MSC治疗组28人(34个糖尿病足)和对照组25人(38个糖尿病足),MSC使用量为(4.8-8.6) x 107/人,所有的病人均接受血管形成术(angioplasty),治疗3个月后,所有病人均有不同程度的改善,包括溃疡面积、局部皮肤温度、踝肱指数(ankle brachial index,ABI)等指标,但是MSC治疗组的改善更加明显;其中治疗组中Fontaine 4级溃疡患者19人,有15人溃疡面痊愈,2人明显缩小、1人没效;MSC在糖尿病足溃疡周边注射有助于提高血管形成术的治疗效果[34](效果见图)。
MSC治疗其他的糖尿病并发症
糖尿病视网膜变性(Diabetic Retinopathy,DR)是仅次于糖尿病足溃疡的第二常见并发症,好发于2型糖尿病患者[35]。研究显示糖尿病视网膜变性患者眼球玻璃体里VEGF的浓度是正常人的10倍[36-38],而且利用VEGF的单克隆抗体拮抗封闭VEGF的活性,反而能提高糖尿病黄斑水肿患者的视力[39, 40]。但是亦有报道MSC能改善视网膜病变动物[41-43]和患者[44]的视力。因此,很难解释能分泌VEGF的MSC却有治疗视网膜变性的功效。或许MSC改善视网膜变性的机理不在于分泌VEGF?除了MSC,眼球内注射自体骨髓造血干细胞(或骨髓单个核细胞)亦能提高视网膜病变水肿患者的视力。
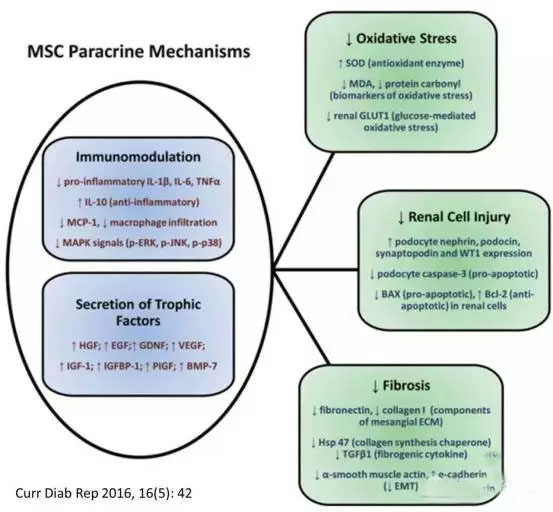
糖尿病引发的肾病并不罕见,动物实验均证明MSC治疗糖尿病肾病的有效性[51-58],机制在于MSC分泌的细胞生长因子的旁分泌作用[58]、抑制氧化应急和炎症反应[53]、减少肾细胞的凋亡[57]、抑制巨噬细胞的浸润和激活[54, 56],甚至MSC能阻止糖尿病肾病进展为肾衰[52]。关于MSC治疗糖尿病肾病的详细机制可参照下图,核心在于MSC的旁分泌作用[59]。但是暂时没发现MSC治疗糖尿病肾病的临床研究报道。
链脲霉素(STZ)诱导的糖尿病大鼠,其骨髓MSC增殖能力和分泌细胞生长因子水平下降,导致其不能有效减轻糖尿病大鼠的肾损伤,但是脐带组织提取物能激活恢复其骨髓MSC治疗糖尿病肾损伤的功效[60]。这个今年在scientific reports杂志发表的文章也证明了在第一部分中所论述的研究结果:糖尿病骨髓MSC的功能受损是暂时性的和可逆性的,给与恰当的治疗干预,能够逆转糖尿病骨髓微环境对MSC的损伤。

另外,暂时没发现或留意MSC治疗糖尿病其他的并发症的报道,有待补充。
上一篇:没有了
下一篇:没有了